Alapfogalmak:
Állatrendszertan: Az állatok rendszerezésével foglalkozó tudomány. ... Fontosabb rendszertani kategóriái, a nagyobbaktól az alsóbb kategóriákig haladva: Birodalom-Ország-Alország-
Légy: A házilégy (Musca Domestica) a rovarok (Insecta) osztályának két szárnyúak (Diperta) rendjébe, ezen belül az igazi legyek (Muscidae) családjába tartozó faj.

Keresztespók: A koronás keresztespók (Araneus diadematus) a pókszabásúak ( Arachnida) osztályának pókok (Araneae) rendjébe, ezen belül a keresztespókfélék( Araneidae) családjába tartozó faj... A keresztespókok általában hálójuk közepén ülnek, néha egy félreeső szögletben várakoznak a hálójukba repülő rovarokra. A csapdába esett rovart először csáprágójában lévő méregmirigy segítségével megbénítja, majd burkot sző köré, szerveit cseppfolyósítja és felszívja.
Anyagcsere: Az anyagcsere (metabolizmus) egy orvosi és biokémiai fogalom, mely az élő szervezetekben végbemenő anyag-, energia- és információáramlást jelenti. A metabolizmus során a környezetből a szervezetbe, sejtbe kerülő tápanyagok lebomlanak, átalakulnak a sejt saját anyagaivá. A lebontó reakciók összességét katabolizmusnak, a felépítő reakciókat anabolizmusnak nevezzük. Az anabolikus és katabolikus reakciók együtt jelentik a metabolizmust.
Biokémia: A biokémia ... az élő szervezetek kémiai felépítését és a bennük végbemenő kémiai változásokat tanulmányozó tudományterület. Célja annak megállapítása, hogy az életjelenségek hogyan függnek össze az élő anyagban végbemenő kémiai változásokkal, azok energetikai viszonyaival, és milyen szabályozó mechanizmusok állnak az események mögött.
Emésztés: Az emésztés a szilárd vagy folyékony állapotban felvett táplálék átalakítása a szervezet sejtjei által felszívható és felhasználható anyagokká.
Külső emésztés: külső emésztésről van szó, ha a szájnyíláson keresztül az állat emésztőenzimeket bocsájt a táplálékára és ezért az emésztés már a testen kívül megkezdődik ( egyes rovarok, pókszabásúak).
Belső emésztés: A legtöbb esetben az emésztés az állat testén belül, a bélcsatornában történik. Ezt a folyamatot nevezzük belső emésztésnek.
Pókméreg: Erről egy német cikket találtam. Eredetileg le szerettem volna fordítani az egészet, de aztán meggondoltam magam. Összefoglalom neked, miről szól. A pókméregnek kettős hatása van. Elsődlegesen bénítja az idegrendszert, ami nehezíti a zsákmány mozgását. Másodlagosan az anyagcsere folyamatokat és az energiaháztartást teszi tönkre. Gyulladást okoz és a szövetek olyan fajta károsodását, ami által jobban terjed a méreg. Rontja az összes életfunkciót. A pókméreg RNS- t, alfa-amilázt, és egyéb peptideket és fehérjéket tartalmaz.
Pókháló: Erról is egy német cikkben olvastam, ami gyerekeknek szól. A pókháló pókselyemből áll. Ez ötször nagyobb szakítószilárdságú az acélnál ugyanakkor nyújtható, és vízálló. A pókfonal olyan szálak kötegéből áll, amelyek fehérje molekula láncokból állnak. A pókfonal a szerkezete miatt egyedülálló. A fehérje láncok egy része spirálrugót alkot, a másik részük pedig olyan masszív mint a vas. Ennek köszönhető, hogy szilárd és rugalmas egyszerre.
Szakítószilárdság: A szakítószilárdság, (σm, Rm) egy kötél,huzal, tartógerenda, vagy más hasonló szerkezeti elem elszakításához szükséges mechanikai feszültség. A szakítószilárdság az anyagnak csak az állandó terheléssel szembeni szilárdságára ad felvilágosítást, dinamikus igénybevételt csak jóval kisebb feszültségnél bír ki az anyag.
Idegrendszer: Az idegrendszer specializálódott sejtek hálózata, melyek információt szállítanak az élőlény környezetésről és saját magáról, valamint az a szervrendszer, amely irányítja a szervezet többi részét. Az idegrendszer két részre osztható: központi idegrendszerre és környéki idegrendszerre. A neuronok kapcsolatot létesítenek a két rendszeren belül és közöttük is. Az idegekkel foglalkozó tudományt neurológiának nevezzük.
Neurotoxin: A neurotoxinok az exogén kémiai idegrendszeri károsodást okozó toxinok (mérgek),amelyek a fejlődő és az érett idegrendszeri szövetek funkcióit egyaránt károsan befolyásolják. A neurotoxin kifejezést egyaránt használják a már veszélyes mennyiségben neurológiai mérgezést okozó endogén vegyületek osztályozására is. Habár a neurotoxinok gyakran neurológiai pusztítást végeznek a szervezetben, kifejezetten az idegrendszer számára fontos idegi komponenseket támadják meg.
Méreg: Biológiai szempontból méregnek tekinthetünk minden olyan anyagot, amely élő szervezettel érintkezve abban károsodást, betegséget vagy halált okoz – általában kémiai reakció útján vagy más molekuláris szintű tevékenységgel – ha belőle kellő mennyiség jut be az élőlénybe.
Enzim: Az enzimek biokatalizátorok: gyorsítják a szervezetben lejátszódó kémiai reakciók sebességét. Mint minden katalizátor, a reakciósebesség növelését az aktiválási energia csökkentésével érik el, azáltal, hogy a reaktánsok speciális elrendezésével új reakcióutakat nyitnak meg. Fontos megjegyezni, hogy a reakcióra jellemző szabad energia változást nem befolyásolják, azaz csak energetikailag kedvező, spontán módon lezajló (ún. exergonikus) reakciókat katalizálnak.
Aminosav: Az aminosavak (más néven amino-karbonsavak) az élethez alapvető fontosságú szerves vegyületek, amelyek molekulájában aminocsoport (−NH2) és karboxilcsoport (−COOH) egyaránt előfordul, valamint tartalmaznak az egyes aminosavakra jellemző oldalláncokat (R csoport) is. Molekuláik főként szénből, hidrogénből, oxigénből és nitrogénből épülnek fel. ...A víz után a fehérjékké összekapcsolódott aminosavak a legnagyobb számban előforduló komponensek az emberi izomzatban és egyéb szövetekben.
Fehérje: A fehérjék egy szabályosan ismétlődő elemekből álló molekuláris gerinchez, az ún. peptid gerinchez kapcsolódó aminosavak láncolatából álló makromolekulák.... A fehérjék kialakításában a 20 féle " proteinogén" ( fehérjealkotó) aminosav vesz részt, melyek szomszédos amino- és karboxilcsoportjaik között kialakuló peptidkötés révén kapcsolódnak egymáshoz, így kialakítva a fehérjék elsődleges szerkezetét, amit aminosav-szekvenciának nevezünk.
RNS: A ribonukleinsav(RNS) a DNS- hez hasonló polimer óriásmolekula, amely sok ismétlődő egységből épül fel. Egységei a ribonukleotidok. A ribonukleotidok száma egy RNS- molekulán belül 75-től több ezerig terjedhet. Minden ribonukleotid egy ribóz cukormolekulából, egy nitrogéntartalmú szerves báziból és egy foszfátcsoportból áll.
DNS: A dezoxiribonukleinsav ( közismert magyar rövidítése DNS) a nukleinsavak (nukleitidból felépülő szerves makromolekulák) csoportjába tartozó összetett molekula, amely a genetikai információt tárolja magában, ez az örökítőanyag. A DNS esetében a nukleotidok három következő komponensből épülnek fel: heterociklusos bázisok(adenin-A, guanin-G, citotin-C, timin-T), pentóz ( dezoxiribóz- pontosabban 2-dezoxi-béta-D- ribóz) és végül a harmadik alkotóelem a foszforsav.
Bázis: Bázisnak, lúgnak vagy aljnak nevezzük a hétköznapi életben azokat a vegyületeket, amelyek vízben oldódva hidroxidiont szabadítanak fel, ezáltal a vizes oldat kémhatását növelik( 7,0 pH- nál nagyobb lesz). A bázisok protonátadással való reakció során protont vesznek fel, vizes oldatuk lúgos kémhatású.
Peptid: A peptidek meghatározott sorrendben összekapcsolódó alfa- aminosavakból felépülő rövid polimerek. A két aminosavmaradék között amidkötés vagy más néven peptidkötés alakul ki.
Alfa-amiláz: Az alfa- amiláz a keményítő cukrokká bontását végző enzimcsalád, az amilázok egyik típusa...
Szénhidrát: A szénhidrátok vagy tudományos néven szacharidok a növények által, fotoszintézis során termelt, szén-, oxigén- és hidrogéntartalmú szerves vegyületek, amelyekben a H:O arány legtöbbször 2:1 (mint a vízben), ezért régen a szén hidrátjának gondolták őket. A szénhidrátok hevítéssel vagy erélyes vízelvonószer hatására ( például tömény kénsav) szénre és vízre bonthatók... A szénhidrátok közé tartozik például a szőlőcukor (glükóz), a gyümölcscukor(fruktóz), a répa- vagy nádcukor( szacharóz), a keményítő és a cellulóz.
Energia megmaradás törvénye: Az energiamegmaradás azt állítja, hogy egy izolált rendszer teljes energiája állandó marad. Más szavakkal az energia átalakítható egyik formájából a másikba, de nem lehet létrehozni, vagy megsemmisíteni.
Ennél bonyolultabban már nem szeretnék belemenni természettudományos szempontból. Ebben most van biológia, és fizika is jócskán. Remélem nem zavar titeket. A természet törvényei elnevezéstől függetlenül működnek. Csak ugye a tudósok igyekeznek külön tudomány ágakra választani a jelenségeket,hogy könnyebb legyen vizsgálni.
Mi történik, ha egy légy bekerül a pókhálóba?
Ehhez is németül találtam egy olyan videót, amit használhatónak gondolok. Leírom nektek összefoglalva azt, amiért ezt a hogy is mondjam elég sok alapfogalmat összeírtam. Kezdem azzal, hogy mi történik, ha nem menekül meg a légy.
A. Belerepül a pókhálóba ugye a legyünk, aztán jól beleragad. Odamegy hozzá a pók, megmérgezi, belerakja az emésztő enzimjeit, körbetekeri, megvárja míg megemésztődik, aztán a megemésztett részeit megeszi. A légy szempontjából az történik, hogy lebénul és nagy fájdalmak közepette folyamatosan mennek tönkre az életfunkciói mígnem elpusztul.
B. A második esetben az történik, hogy még a pók érkezése és mérgezése előtt kiszabadul a légy. Rajta marad a pókháló a testén, és vagy a kitin páncéljának egy része vagy a szárnyának egy része marad a pókhálón. Vagy azért mert ő maga nagyobb mechanikai feszültséget hoz létre, mint amekkora a pókháló szakítószilárdsága, vagy valamilyen külső behatásra.
Hogyan szabaduljunk ki egy nárcisztikus hálójából?
Most jön az a rész, mi történik párkapcsolati, vagy bármilyen kapcsolati szempontból: ezeket a nárcisztikus, pszichopata, bántalmazó szavakat szinonimaként fogom, használni, mert abból a szempontból, amire használni szeretném ugyanazt jelenti.
Az elején még kitérek erre, mit jelentenek pontosan ezek a szavak. Találtam erről egy videót, hogyan lesz valakiből bántalmazó. Röviden arról van szó, hogy akit gyerekként bántottak, vagy pedig aki valakitől ezt látta, hogy bánt másokat, és átvette tőle ezt a mintát. Úgy tudod eldönteni, hogy bántalmazó vagy e, hogy romboló hatással vagy e a környezetedre, vagy sem.
Sok Bihari Vikis videót fogok nektek belinkelni, íme itt egy arról, ki a pszichopata. Röviden azt jelenti, hogy valamiért nem tud valaki hozzáférni az érzelmeihez. Vagy azért, mert úgy született, vagy mert érte valami trauma.
Akkor jöjjön ki a nárcisztikus." A nárcisztikus tulajdonságokkal ellátott – emberrel nem az a baj, hogy szereti önmagát, hanem az, hogy megrekedt az önszeretetben... és nem tud továbblépni tényleges célja felé."(Sorskönyv nélkül blog - 10. séma: Feljogosítottság- grandiozitás című cikk)
Most jöjjön az, hogy ki lesz az áldozat. "Senki sem véletlenül pottyan egy olyan helyzetbe, hogy akár agresszor, akár áldozat legyen. E kapcsolatok a személyes élettörténet szerves és logikus részeként alakulnak ki, amelyet megelőz számos tudatos és még több tudattalan, ún. korai döntés. A ma bántalmazott áldozatok kisgyerekként nagy valószínűséggel olyan üzeneteket kaptak környezetükből, amelyek révén sorskönyvükbe beépítették a Ne létezz!, Ne légy fontos!, Ne érezz! gátló parancsokat, megspékelve a Légy erős! és Szerezz örömet másoknak! ellensorskönyvi utasításokkal."(Sorskönyv nélkül blog - Asszony verve jó című cikk) Két dolgot szeretnék tisztázni, egyrészt nem csak a nők lehetnek áldozatok, másrészt pedig senki sem csak áldozat vagy csak bántalmazó.1. Nézzünk szembe a fájdalommal!
2. Lépés: Teremtsünk egy pozitív jövőképet!
3. Lépés: Döntsünk, hogy megyünk, vagy maradunk!
4. Lépés: Ismerjük fel a sémáinkat!
5. Lépés: Szakítsuk el a kötelékeket!
Egy legyet is egy csomó félelem megbéníthat. Megijedhet, hogy nem tud mozogni, és jön felé egy hatalmas pók. Egy ilyen kritikus helyzetben egy csomó félelmetes dologgal találhatjuk szembe magunkat. Mutatok neked erről is Almási Kittis videókat, hogyan nézz szembe a félelmeiddel. Van egy rövidebb és egy hosszabb. Amennyit én erről tudok, egy bántalmazó nem szokta díjjazni, ha ott akarják hagyni. Félhetünk az ismeretlentől, attól, hogyan fogja ezt fogadni a környezetünk. Főleg, ha válni készülsz, akkor az idősebb, konzervatívabb és kicsit is bigottabb emberek nagyon le fognak téged nézni. Én attól féltem a legjobban, hogy el fog hagyni Isten. Úgy tudtam, hogy az eskü szövegben az Isten engem úgy segéljen azt jelenti, hogy addig segítsen Isten, amíg betartom az eskümet. Később megtapasztaltam, hogy Ő nem hogy nem hagyott el, hanem még közelebb kerültünk egymáshoz. Van egy ilyen nagyon szép ének is erről, hogy az emberek elhagyhatnak, és sokan el is fognak hagyni, de Isten veled marad. Nem maradt más hátra, mint az utolsó és valószínűleg legnehezebb lépés.
7. lépés: Cselekedjünk!
Egy légynek is egy ilyen csapda helyzetben, ha élni akar az a dolga, hogy szakítsa ki magát a hálóból, és repüljön el, amilyen gyorsan csak tud. Az a lényeg, hogy kezdd el felvenni a kapcsolatot azokkal a barátaiddal, akiktől igyekezett elválasztani a párod. Egyedül ezt nem tudod megoldani, kérj segítséget. Gondold végig, hogy ki az a múltadból, akitől sok szeretetet kaptál és aki szívesen segítene neked. Szerencsére nekem nem kellett hozzájuk folyamodnom, mégis belinkelem a NANE ( Nők a nőkért együtt az erőszak ellen egyesület) elérhetőségét. Ha nagyon rosszul vagy lelkileg, akkor ezt a számot ingyenesen, anonim módon hívhatod:116-123, ők a lelki elsősegély szolgálat. Leírom neked az általános segélyhívó számokat: mentők: 104 , rendőrség : 107 , tűzoltóság: 105 , általános segélyhívó: 112 . Találtam neked egy videót erről, hogyan kérj segítséget. Hogyan fogadd el, hogy vége a kapcsolatnak. Miért menj pszichológushoz, vagy valamilyen terápiába. Ehhez azt fűzném hozzá, hogy nem az a dilis, meg nem annak kell magát szégyellni, aki segítséget kér. Hanem az a dilis és az szégyellje magát, aki bántja emiatt egy embertársát, akinek sikerül rászánni magát, hogy segítséget kérjen. Ami a legfontosabb, hogy indulj el és ne nézz hátra ! Készítettem egy összefoglaló videót arról, amiről eddig írtam.

 Egy ideje gyesen vagyok az iker fiaimmal. Tehát nem dolgozok most a laborban, de szívesen folytatom a blogot. Érdekel a kémia. Szívesen olvasok és írok róla. Most ezt szeretném nektek, bemutatni: hogyan oldódik a jód különböző oldószerekben.
Egy ideje gyesen vagyok az iker fiaimmal. Tehát nem dolgozok most a laborban, de szívesen folytatom a blogot. Érdekel a kémia. Szívesen olvasok és írok róla. Most ezt szeretném nektek, bemutatni: hogyan oldódik a jód különböző oldószerekben.  Ezt a bejegyzést nagyon rég hagytam félbe. Ami miatt szeretném befejezni és megmutatni nektek, mert úgy tűnik van létjogosultsága a blogomnak. Az eddigi bejegyzéseimet megnéztem hányan olvassátok és elég sokan. Amiről most szeretnék írni az az ezüsttükörpróba. Ez az egyik leginkább alapműveltségnek számító kísérlet. Amit hozzá fűznék a könnyebb megértéshez: Mi az a funkciós csoport, oxocsoport, az aldehid, a redukció, az ion, a vegyület és a kémiai komplex.
Ezt a bejegyzést nagyon rég hagytam félbe. Ami miatt szeretném befejezni és megmutatni nektek, mert úgy tűnik van létjogosultsága a blogomnak. Az eddigi bejegyzéseimet megnéztem hányan olvassátok és elég sokan. Amiről most szeretnék írni az az ezüsttükörpróba. Ez az egyik leginkább alapműveltségnek számító kísérlet. Amit hozzá fűznék a könnyebb megértéshez: Mi az a funkciós csoport, oxocsoport, az aldehid, a redukció, az ion, a vegyület és a kémiai komplex. 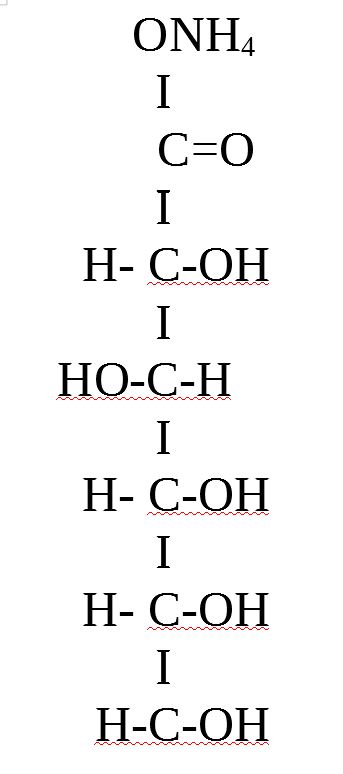
 Szeretném folytatni ezt a blogot egy nagy kihagyás után. Ami most leginkább foglalkoztat kísérlet, az a lángfestés. A hozzá kapcsolódó alapfogalmak a foton, az elektron, a hullámhossz és a gerjesztés, és persze az alkálifémek és az alkáliföldfémek.
Szeretném folytatni ezt a blogot egy nagy kihagyás után. Ami most leginkább foglalkoztat kísérlet, az a lángfestés. A hozzá kapcsolódó alapfogalmak a foton, az elektron, a hullámhossz és a gerjesztés, és persze az alkálifémek és az alkáliföldfémek. 
 Ennek a vegyész virágoskert nevű kísérletnek a központi eleme az ozmózis. Milyen fogalmak tartoznak az ozmózishoz? Az első a diffúzió: egy oldat részecskéi mindig a nagyobb koncentráció felől haladnak a kisebb koncentráció felé, mígnem egységes lesz az oldat koncentrációja. A másik, amit érdemes lehet tudnod, hogy mit jelent a félig áteresztő hártya. Ez egy olyan hártya, ami két oldat között van, és a kisebb részecskéket átengedi és a nagyobbakat visszatartja. Ezek után az ozmózis azt jelenti, két különböző töménységű oldat közt egy félig áteresztő hártya van, és úgy egyenlítődik ki a két oldat koncentrációja, hogy azok a részecskék, amik átférnek a félig áteresztő hártyán átdiffundálnak az egyik oldatból a másikba. Van még egy fogalom az ozmózis nyomás. Ez azt az erőhatást jelenti, amit az áramlás során a hígabb oldat a félig áteresztő hártyára fejt ki.
Ennek a vegyész virágoskert nevű kísérletnek a központi eleme az ozmózis. Milyen fogalmak tartoznak az ozmózishoz? Az első a diffúzió: egy oldat részecskéi mindig a nagyobb koncentráció felől haladnak a kisebb koncentráció felé, mígnem egységes lesz az oldat koncentrációja. A másik, amit érdemes lehet tudnod, hogy mit jelent a félig áteresztő hártya. Ez egy olyan hártya, ami két oldat között van, és a kisebb részecskéket átengedi és a nagyobbakat visszatartja. Ezek után az ozmózis azt jelenti, két különböző töménységű oldat közt egy félig áteresztő hártya van, és úgy egyenlítődik ki a két oldat koncentrációja, hogy azok a részecskék, amik átférnek a félig áteresztő hártyán átdiffundálnak az egyik oldatból a másikba. Van még egy fogalom az ozmózis nyomás. Ez azt az erőhatást jelenti, amit az áramlás során a hígabb oldat a félig áteresztő hártyára fejt ki.